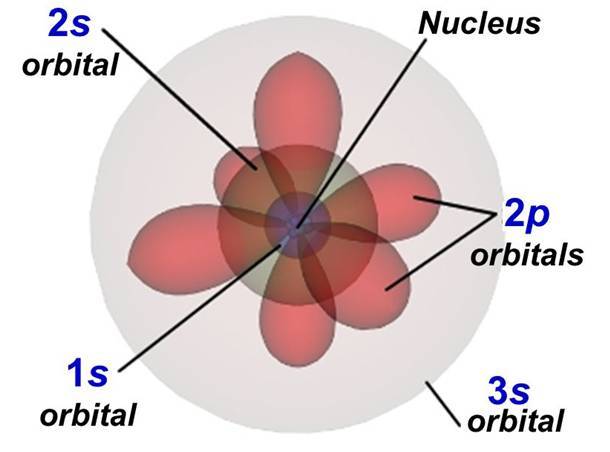
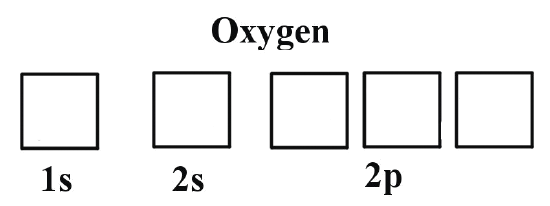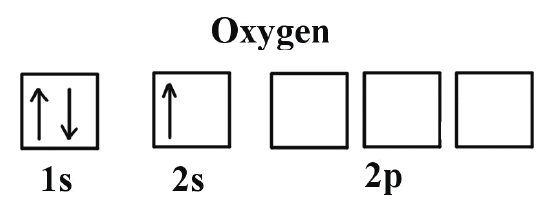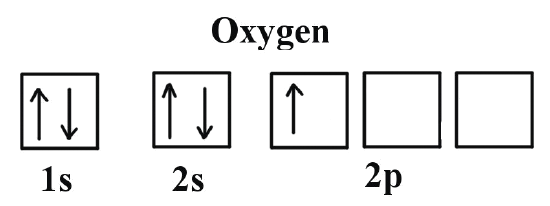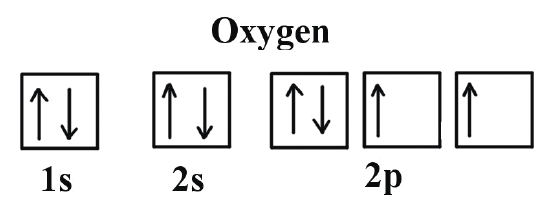Los átomos están formados por dos partes principales: los núcleos, donde se encuentran los protones y los neutrones, y los orbitales, donde puedes encontrar a los diminutos electrones. Pero algo que tal vez no sabías es que estos electrones no se colocan en cualquier parte, sino que tienen manías y preferencias que se parecen mucho a las que tenemos los humanos cuando escogemos dónde sentarnos en un autobús.
Los orbitales y los pisos del autobús
Imagina que vives en Londres, una ciudad emblemática con unos autobuses rojos de dos pisos como símbolo. Esperas en tu parada y, cuando llega el autobús, ves que está vacío y puedes escoger cualquier asiento para sentarte.
¿Qué asiento escogerías?
Si fueras un simple turista en Londres, estoy seguro que escogerías el piso de arriba; con la ilusión de un niño subirías y admirarías las vistas de la ciudad. Pero siendo un residente habitual que utiliza este autobús cada día de la semana lo más probable es que te quedarás en el piso de abajo. ¡Qué pereza subir unas escaleras tan estrechas…!
Es mucho más fácil y cómodo quedarse en el piso de abajo. Y es exactamente esto lo que hacen los electrones, van llenando los diferentes pisos según el esfuerzo que les suponga estar en cada uno de ellos.
Los electrones y la pereza
Los pisos del autobús son los diferentes orbitales del átomo, las regiones donde pueden estar los electrones. Primero se llenarán los orbitales que requieran menos esfuerzo para el electrón, los orbitales con menos energía, exactamente igual que los pasajeros habituales del autobús. Pero, ¿qué es lo que hace que cada piso tenga una energía u otra?
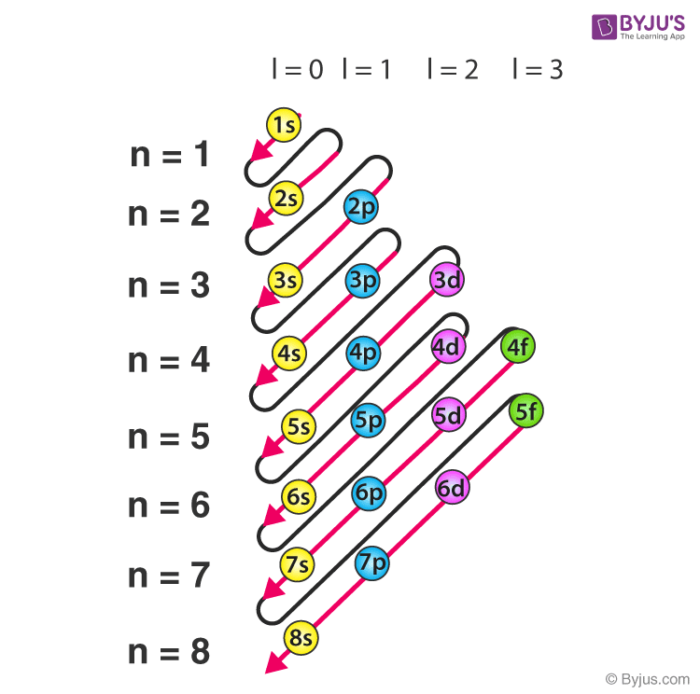
- La distancia al núcleo del átomo, o la altura a la que está el piso. Cuanto más bajo esté el piso, menos energía añadirá al total. Por ejemplo, el primer piso (n=1) tiene menos energía que el segundo (n=2) por este efecto. Cada piso tiene un nombre asignado: s (n=1), p (n=2), d (n=3), f (n=4), g (n=5).
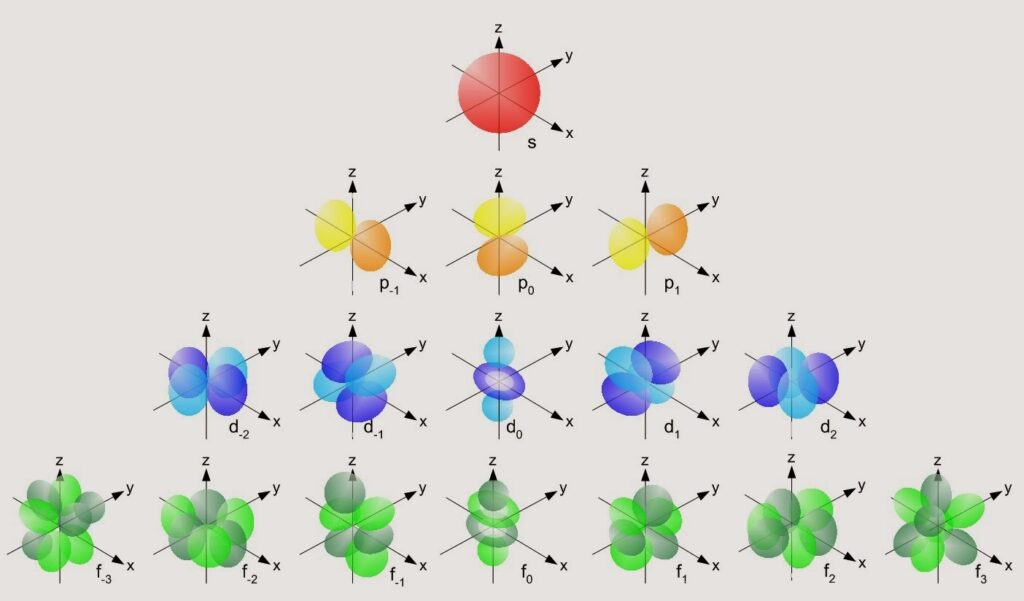
- La forma del orbital, o el número de asientos del piso. En los átomos, la forma del orbital define cuánta energía de rotación tiene el electrón, ya que define como girará. Cuantos más pares de asientos disponibles haya en el piso, más grande tendrá que ser, y por tanto «más pereza» nos dará tener que buscar un sitio en él.
Así, la energía de cada piso se puede comparar sumando el número de pares de asientos del piso y la altura a la que está el piso. Un orbital tendrá más energía que otro si su (n+l) es más grande que el de otro orbital.
Fuente: elfisicoloco.blogspot.com
Los asientos y la regla de Hund
Una vez estás en el piso que más te conviene, llega el que tal vez es el momento más tenso de todo el proceso: elegir un asiento.
El primer viajero en llegar no tendrá demasiados problemas para elegir, y probablemente escoja el asiento que tenga más cerca. Lo interesante viene cuando vienen los siguientes pasajeros del bus atómico: los nuevos viajeros que suban al bus se colocarán en las isletas de 2 que todavía están vacías, evitando molestar a los viajeros que ya están sentados y poniéndose poner bien cómodos.
¡Y los electrones hacen exactamente lo mismo!
Esta «manía» de evitarse que tienen los electrones se conoce como Regla de Hund, y les permite tener menos influencia eléctrica por parte del resto de electrones del átomo, estando bien repartidos en los diferentes orbitales (o pares de asientos) del mismo piso.
Pero… ¿Qué pasa cuándo todos los pares de asientos ya tienen un viajero?
Un autobús con tapicería de ALSA llenándose por personas representadas por flechas
Comodidad y el principio de exclusión de Pauli
A los pobres electrones, al igual que los pasajeros del bus, no les queda otra que compartir asiento con otro. Pero hay un detalle muy importante: estos no se pueden colocar de la misma manera que el electrón que ya está en el orbital o, en nuestra analogía, que el pasajero que ya está sentado. Esto ocurre por el principio de exclusión de Pauli, que no permite que dos electrones puedan estar en el mismo estado cuántico.
Esto decir que los dos electrones no pueden tener las mismas propiedades y estar en el mismo lugar simultáneamente. No pueden ser lo mismo en el mismo sitio y, ya que están en la misma isleta de asientos, una de sus propiedades tiene que ser diferente a la del electrón que ya está sentado.
El ‘spin’ y ponerse cómodo
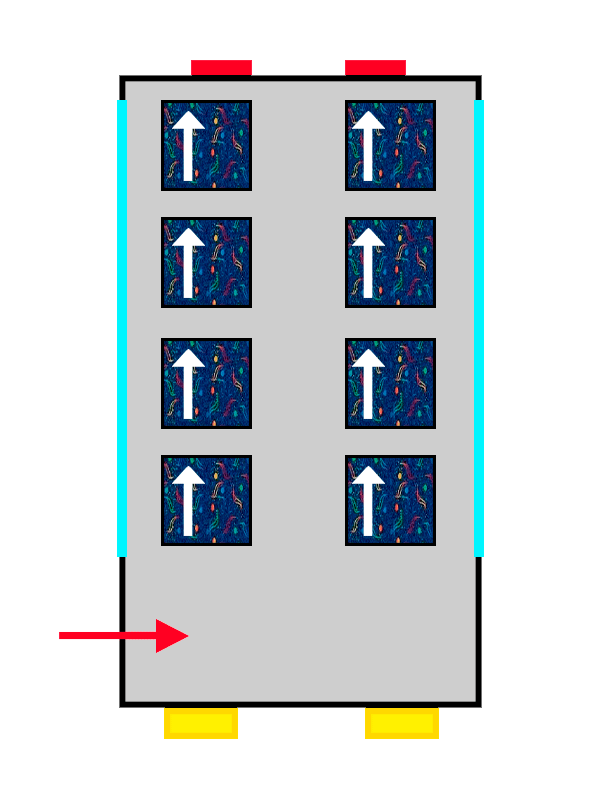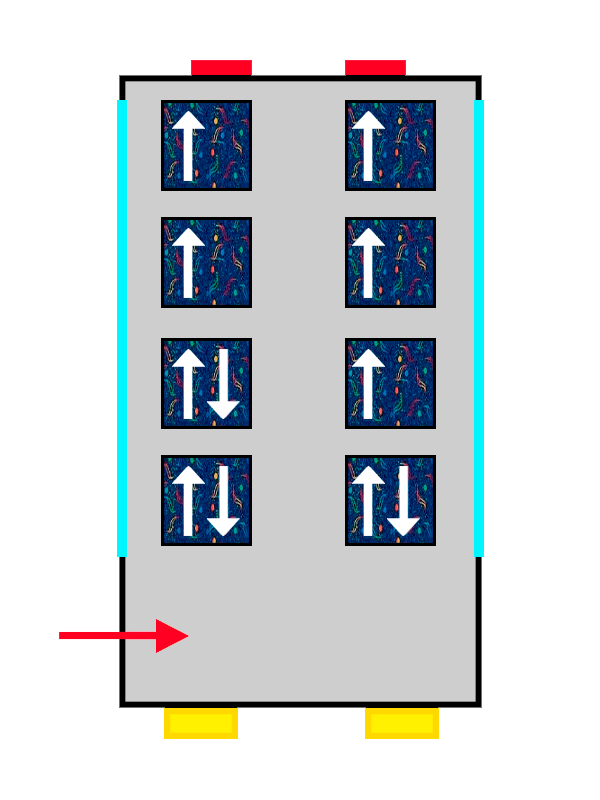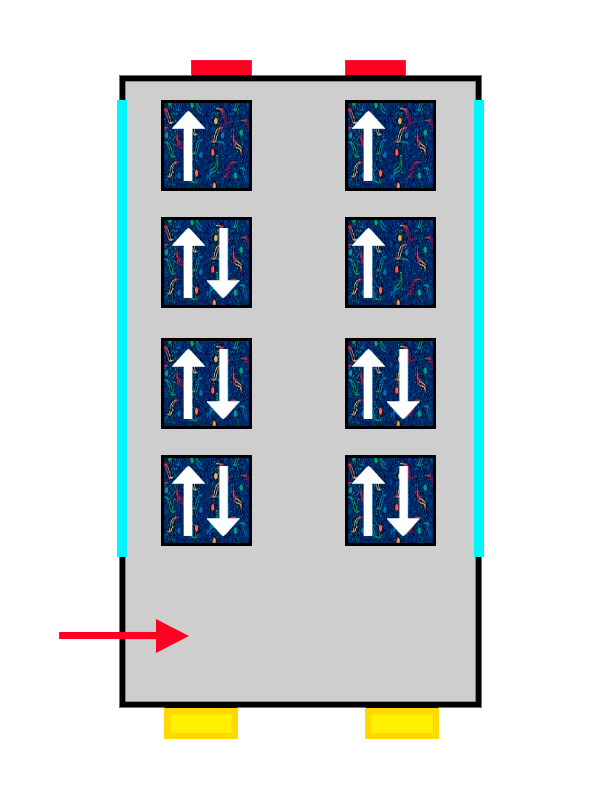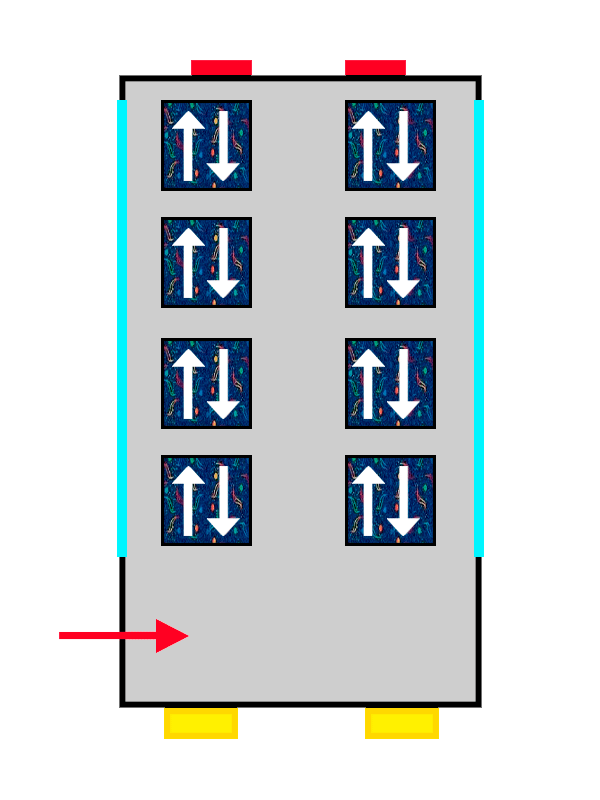
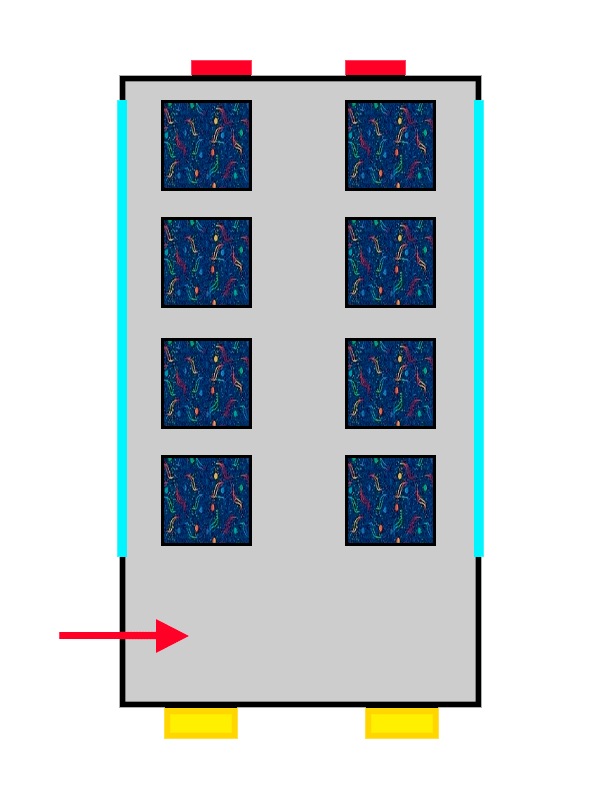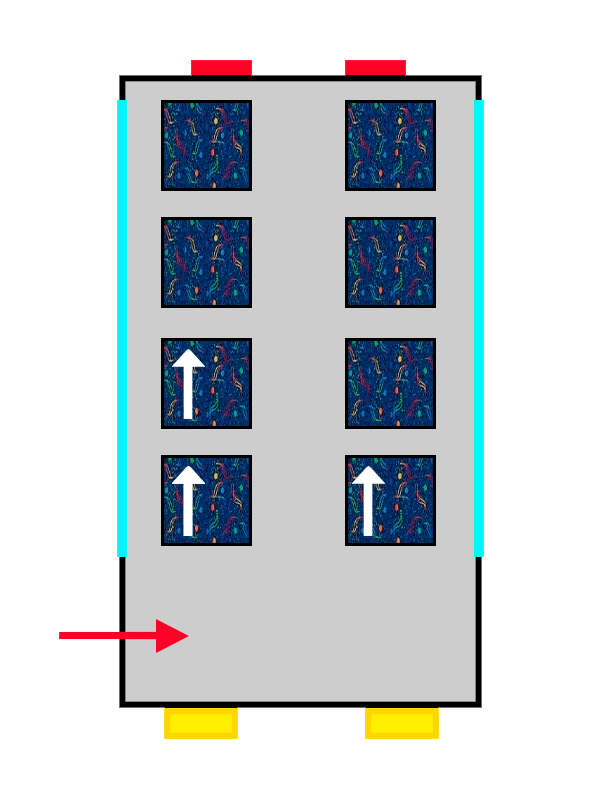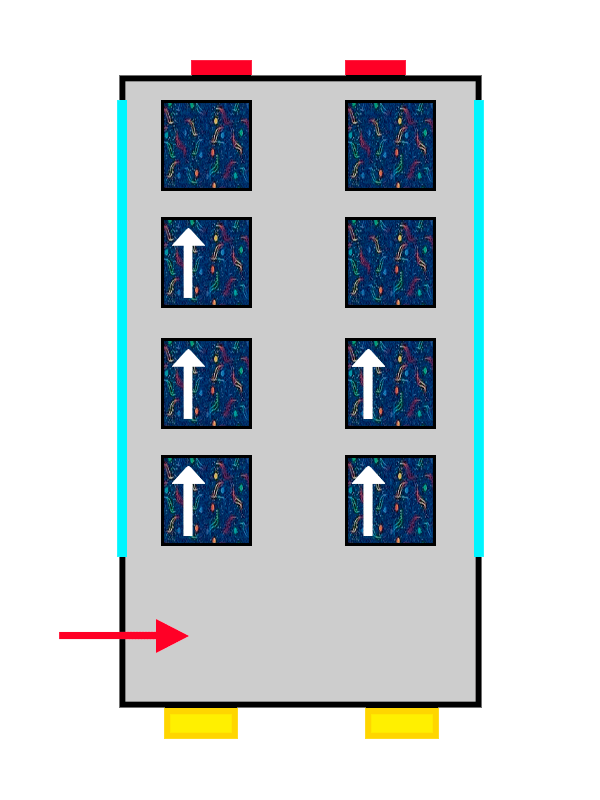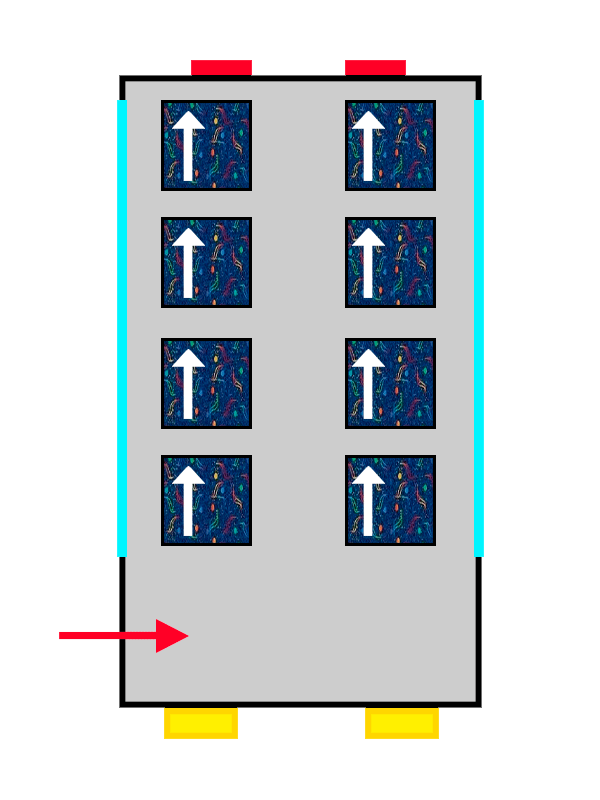
El mismo autobús con tapicería de ALSA llenándose con los últimos pasajeros en entrar.
Y la propiedad que cambia para que quepan más electrones es el ‘spin‘. El ‘spin’ es una propiedad cuántica muy compleja que representa la rotación intrínseca que tiene el electrón. Algo así como la energía de rotación que tiene por sí mismo, sin influencia de ningún factor externo. Hablaremos más del ‘spin’ en otra ocasión, pero lo importante es que ha de ser diferente para los electrones en un mismo orbital.
Así que los electrones que llegan primero al orbital se colocan con su ‘spin’ positivo (una flechita hacia arriba) bien cómodos y anchos, mientras que el segundo no tiene más remedio que colocarse con su ‘spin’ negativo (una flechita hacia abajo), más apretado y estrecho.
Lo mismo pasa con nuestros pasajeros: el primero se ha puesto muy cómodo, así que el segundo no puede ponerse tan ancho y tendrá que apretarse más. Los electrones se colocan hasta llenar completamente el orbital en el que estén, hasta que no quedan más asientos libres en el piso. Y, si no hay más, pasan al siguiente siguiendo exactamente las mismas reglas.
Un ejemplo con un elemento real
Ahora que entiendes como los electrones se colocan dentro del átomo, seguro que tienes curiosidad de ver un ejemplo real. Vamos a usar el oxígeno, que tiene 8 protones en su núcleo y 8 electrones en sus orbitales.
Los primeros electrones se quedan en el primer «piso», el orbital 1s. Uno se sienta con su ‘spin’ positivo (hacia arriba) y el otro con su ‘spin’ negativo (hacia abajo). En el segundo «piso», el orbital 2s, pasa exactamente lo mismo ya que hay la misma cantidad de asientos. Ya se han colocado 4 de los 8 electrones.
Así que los 4 restantes suben al último piso, el orbital 2p. Los electrones se van colocando bien anchos y cómodos con su ‘spin’ positivo, hasta ocupar uno de los asientos de cada par. Cuando llega el último, no tiene más remedio que sentarse al lado de otro electrón y se coloca con su ‘spin’ negativo. Todos los electrones del oxígeno se han colocado de la manera que da más estabilidad al átomo o, lo que es lo mismo, han encontrado la configuración de menos energía.